의료기기를 해외에 출시하려면 단순히 제품만 잘 만든다고 끝이 아니에요. 각국의 규제기관은 제품의 안전성과 효과를 입증할 수 있는 다양한 자료와 시험 결과를 요구하죠. 특히 유럽(EU)이나 미국(FDA)처럼 기준이 까다로운 시장에서는 더욱 철저한 준비가 필요합니다.
이번 글에서는 의료기기 제조사가 제품 출시 전 반드시 거쳐야 할 주요 절차 10가지를 간단하고 알기 쉽게 정리해봤어요. 복잡한 규제 요건, 어디서부터 시작할지 막막한 분들께 도움이 되길 바랍니다.
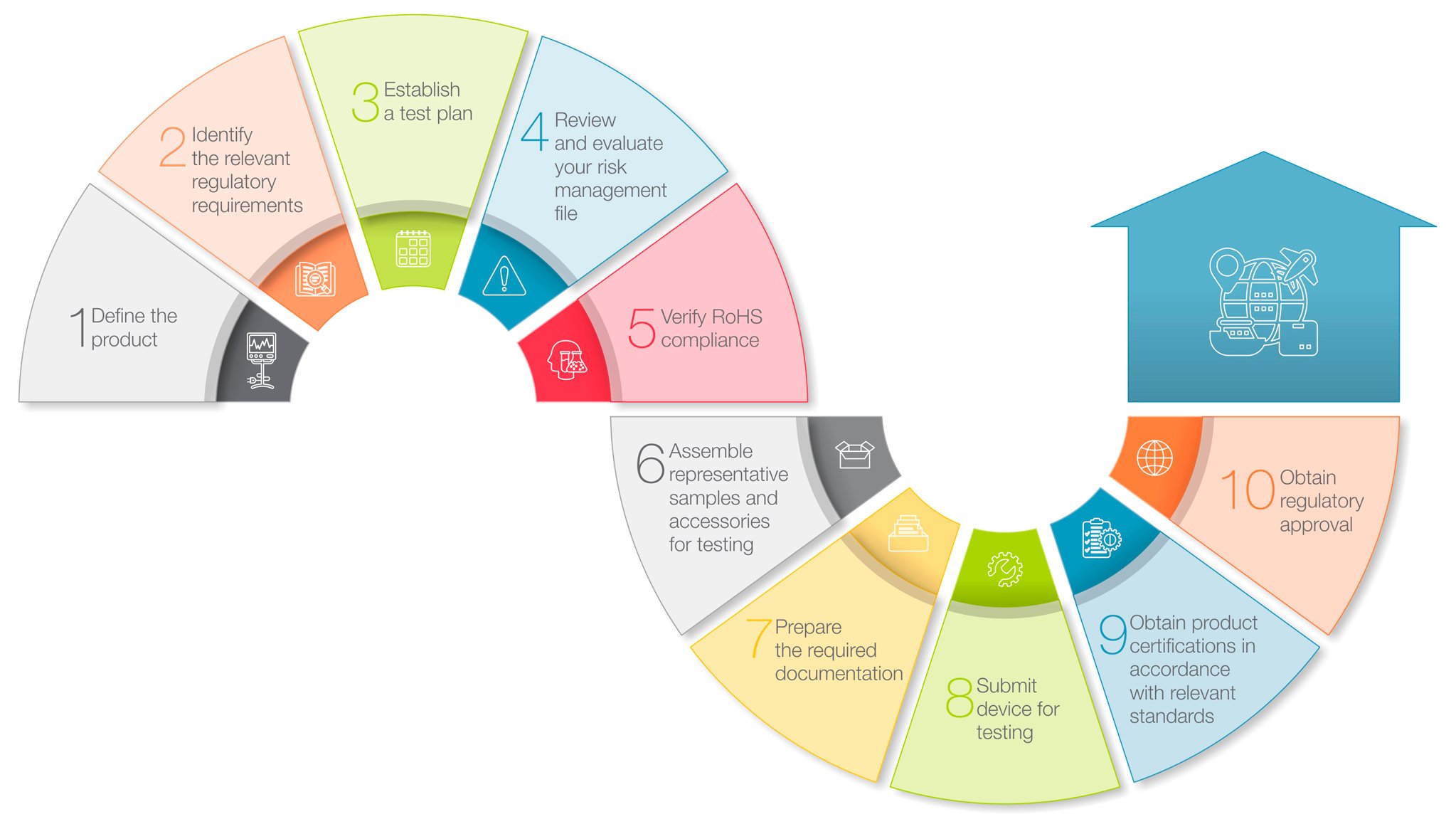
1. 제품 정의하기 ![]()
첫 단계는 바로 제품의 사용 목적과 사용 환경을 명확히 하는 것입니다.
예를 들어, 병원에서 의료 전문가가 사용하는 기기와 가정에서 일반 소비자나 간병인이 사용하는 기기는 적용되는 규제 요건이 다를 수 있어요.
또한 의료기기 규정은 국가마다 차이가 있기 때문에, 어떤 시장에 제품을 출시할지 미리 정해두는 것도 중요합니다. 사용 환경과 시장을 명확히 정의하면, 이후 진행되는 모든 절차의 기준이 훨씬 분명해져요.
2. 관련 규제 요건 확인하기 ![]()
1단계에서 제품 정보를 정리했다면, 이제는 어떤 규제와 기준을 따라야 하는지 파악할 차례예요. 단순히 제품 특성에 맞는 기술 요건뿐 아니라, 많은 국가에서는 회사 전반의 품질관리 시스템(QMS)에 대한 문서나 심지어 ISO 13485 같은 국제 인증도 요구하기도 해요. 이 부분도 꼭 챙겨야 해요.
3. 시험 계획 수립하기 ![]()
기기에 적용되는 규제 요건을 충분히 이해했다면, 이제 그 기준을 충족하고 있다는 걸 데이터로 입증할 수 있도록 시험 계획을 세워야 해요. 특히 위험도가 높은 의료기기의 경우, 안전성과 효과를 뒷받침할 수 있는 임상시험까지 요구될 수 있어요.
4. 리스크 관리 파일 점검하기 ![]()
리스크 관리는 의료기기 개발과 판매 후까지 전 과정에서 핵심적인 역할을 해요. ISO 14971은 제품과 관련된 모든 잠재적 위험을 분석하고, 그 위험을 줄이기 위한 체계를 마련하는 데 도움이 되는 국제 표준이에요. 이미 리스크 관리 파일이 있다면 이 기준에 맞게 잘 정리되어 있는지 꼭 점검해 보세요.
5. RoHS(유해물질 제한) 준수 여부 확인하기 ![]()
일부 국가에서는 납, 수은, 카드뮴, 프탈레이트 같은 유해물질 사용을 엄격하게 제한하고 있어요. 특히 EU에서는 RoHS 지침에 따라 의료기기도 그 대상에 포함되기 때문에, 관련 기준을 충족하고 있다는 증빙 문서를 미리 준비해 두는 게 좋아요.
6. 시험용 샘플 및 액세서리 준비하기 ![]()
이제 실제로 시험에 사용할 제품 샘플과 액세서리들을 준비할 차례예요. 이 샘플들은 최종 제품과 최대한 동일하게 제작되어야 해요. 그래야 실제 사용 환경에서 기능성과 안전성을 제대로 테스트할 수 있거든요. 테스트 중 발생할 수 있는 오작동에도 대비해 여분 샘플도 준비해 두세요.
7. 제출용 문서 정리하기 ![]()
이제까지 준비한 내용을 바탕으로, 시험소나 규제기관에 제출할 문서들을 정리해야 해요. 기본적으로는 다음과 같은 문서가 필요해요:
-
제품 기술 문서 또는 설계 도큐먼트
-
임상 평가 보고서
-
리스크 관리 파일
-
RoHS 관련 자료
-
사전에 수행한 시험 결과 보고서
제품의 위험 등급이나 진출하려는 시장에 따라 추가 문서가 요구될 수 있으니, 꼼꼼히 확인해 두는 게 좋아요.
8. 제품 시험 진행하기 ![]()
의료기기 시험에는 성능, 안전성, 생체적합성 같은 기본적인 항목 외에도, 제품에 따라 전자기적합성(EMC)—예를 들어 무선기능, 정전기 방전(ESD), 전자파 방출 같은 요소—까지 평가하는 경우도 있어요. 기기에 필요한 다양한 시험을 모두 진행할 수 있는 시험소를 선택하는 게 중요해요.
9. 제품 인증 획득하기 ![]()
시험소에서 발급한 시험 보고서를 바탕으로, 이제 제품이 관련 표준을 충족한다는 공식 인증을 받을 수 있어요. 경우에 따라서는 회사 자체에서 발급하는 적합성 선언서(DoC)만으로도 충분할 수 있지만, 일부 기준은 공식 인증기관이 데이터를 검토하고 인증서를 발행해야 해요.
10. 규제기관 승인 받기 ![]()
마지막 단계는 각 국가의 규제기관으로부터 공식 승인을 받는 것이에요. 이 승인을 통해 해당 국가에서 제품을 합법적으로 판매할 수 있게 되죠. 승인 절차나 요구 기준은 국가마다 조금씩 다르지만, EU나 미국에서 먼저 승인을 받으면 다른 나라에서도 승인 절차가 빨라질 수 있어요.

인허가 준비에 필요한 시간, 생각보다 길 수 있어요
의료기기 개발자와 제조사들이 꼭 고려해야 할 또 하나의 중요한 요소는 모든 인허가 절차를 완료하고 최종 승인을 받기까지 걸리는 시간입니다.
이 전체 과정은 보통 몇 개월 이상 걸리며, 경우에 따라 1년 이상 소요되기도 해요.
하지만 이번 글에서 소개한 로드맵을 참고하면, 제품이 관련 요건을 충족하는지 초기에 판단할 수 있고, 준비 과정에서 발생할 수 있는 예기치 않은 지연이나 누락을 최소화하는 데 큰 도움이 됩니다.
관련 규제 요건에 대해 더 자세히 알고 싶으시다면, 아래 메일로 문의해 주시기 바랍니다.
seungyeun SONG
Seungyeun SONG Sales and Marketing in Nemko Korea
